Czym jest hialuronidaza?
Hialuronidaza jest powszechnie występującym w przyrodzie enzymemHialuronidaza
Znaleźć ją można w organizmach kręgowców, gdzie zlokalizowana jest w wątrobie, nerkach, skórze, jądrach oraz płynach ustrojowych, takich jak krew czy łzy. Zdolność wytwarzania hialuronidazy posiadają także niektóre bakterie oraz grzyby.
W organizmie człowieka naturalnie występuje 5 typów hialuronidazy, które są zlokalizowane w różnych miejscach naszego organizmu, gdzie pełnią określoną funkcję.
Podstawowym zadaniem hialuronidazy jest rozkład kwasu hialuronowego, stanowiącego naturalne spoiwo międzykomórkowe w organizmie człowieka. Dzięki temu ww. enzym zwiększa przepuszczalność tkanki łącznej oraz zmniejsza lepkość płynów ustrojowych. Hialuronidaza uczestniczy w ważnych procesach fizjologicznych, począwszy od zapłodnienia, kończąc na starzeniu.
Ze względu na swoje właściwości enzym ten znalazł szerokie zastosowanie w medycynie.
Do dziedzin, w których wykorzystywana jest hialuronidaza, możemy zaliczyć:
Hialuronidaza ma zdolność rozkładu kwasu hialuronowego, co przyczynia się do zwiększenia przepuszczalności tkanek, skutkując przyspieszaniem i ułatwieniem rozprzestrzeniania się płynów/leków podawanych np. drogą podskórną.
Wśród grup leków, gdzie przy podaniu wykorzystuje się opisane właściwości hialuronidazy, wskazać można m.in.:
Po raz pierwszy hialuronidaza została zarejestrowana w 1948 r. Ze względu na fakt, iż produkt pozyskiwano od zwierząt, istniało realne ryzyko rozwoju reakcji alergicznych oraz przeniesienia czynników zakaźnych.
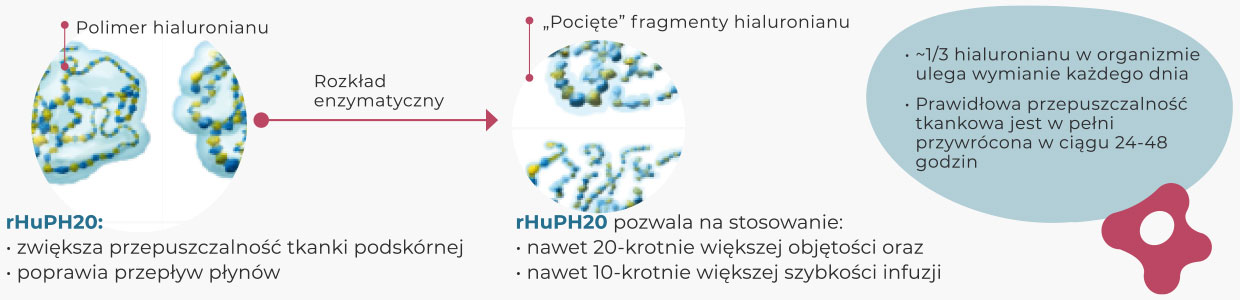
Rekombinowana ludzka hialuronidaza (rHuPH20)
Dopiero w latach 90. XX wieku, dzięki możliwościom, jakie niosła za sobą inżynieria genetyczna, udało się uzyskać rekombinowaną ludzką hialuronidazę (rHuPH20)
rHuPH20 jest 100-krotnie czystszą formą hialuronidazy w porównaniu z tą pozyskiwaną od zwierząt. Rekombinowaną ludzką hialuronidazę można stosować długoterminowo ze względu na wspomniany powyżej wysoki stopień oczyszczenia, jak również brak potencjału do prowokowania stanu zapalnego, brak wpływu na przepuszczalność naczyń czy też mniejszą niż w przypadku produktu odzwierzęcego – zdolność wywoływania reakcji alergicznych.
Obrzęk, który obserwuje się po podaniu rHuPH20, jest minimalny, a efekt jej działania jest całkowicie odwracalny po 24-48 godzinach.
W przypadku stosowania immunoglobulin warto zwrócić uwagę, iż bez hialuronidazy zakresy objętości preparatów, jakie można podać do tkanki podskórnej, wahają się w przedziale 20-60 ml na miejsce podania. W przypadku przekroczenia ww. zakresu obserwuje się znaczące twardnienie tkanki w miejscu podania, zmniejszone wchłanianie oraz ból. Skutkiem tego jest konieczność przeprowadzania częstszych infuzji z wykorzystaniem kilku miejsc podania.
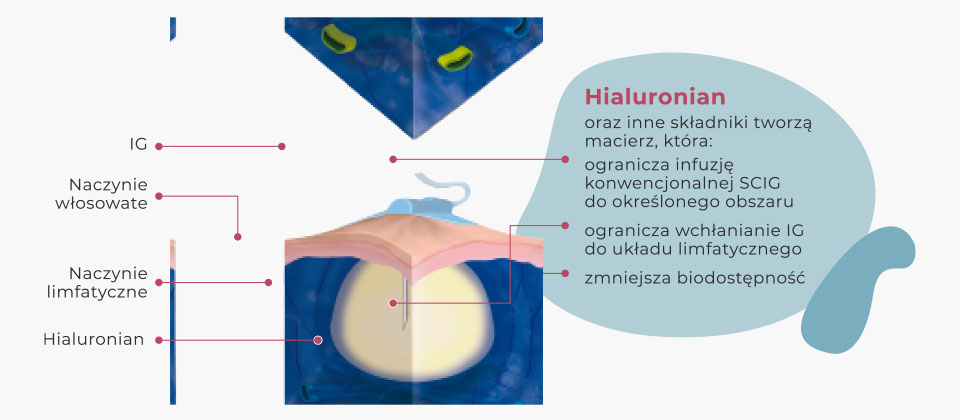
Hialuronian: wypełnia przestrzeń pomiędzy elementami strukturalnymi macierzy zewnątrzkomórkowej tkanki podskórnej
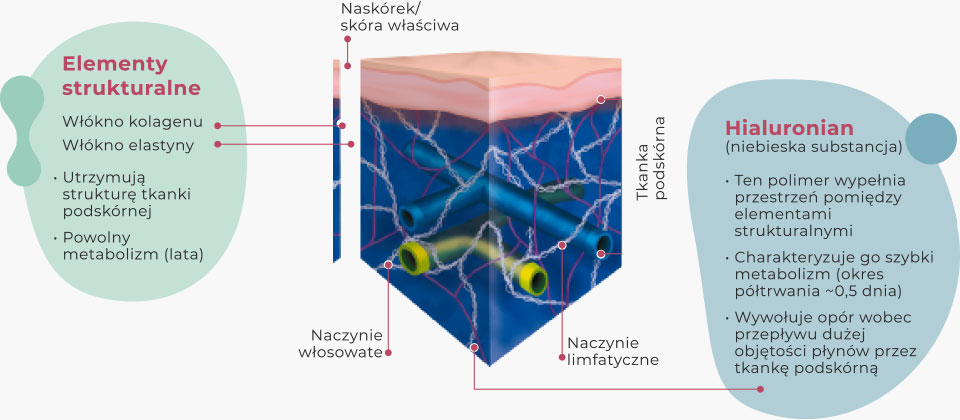
Rekombinowana hialuronidaza ludzka rHuPH20 prowadzi do szybkiego i odwracalnego rozkładu hialuronianu
Objętość i szybkość podawania konwencjonalnej SCIG* jest ograniczona
* SCIG (ang. subcutaneous immunoglobulin) – immunoglobulina do podawania podskórnego.
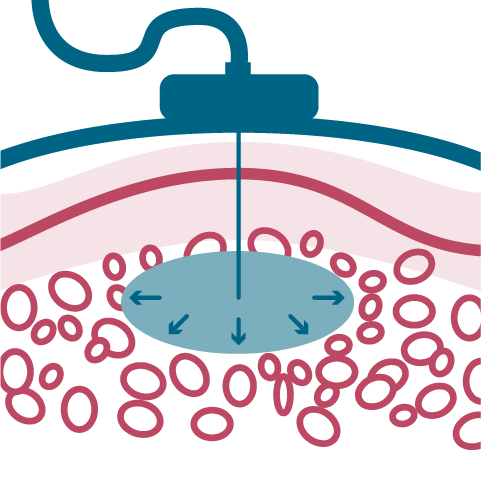
Tkanka podskórna w przypadku infuzji konwencjonalnych SCIG
Przepływ płynów w konwencjonalnych terapiach przez hialuronian obecny w tkance podskórnej. W leczeniu preparatem fSCIG* wykorzystywana jest rekombinowana hialuronidaza ludzka w celu zwiększenia masowego przepływu płynów przez włókna kolagenowe.
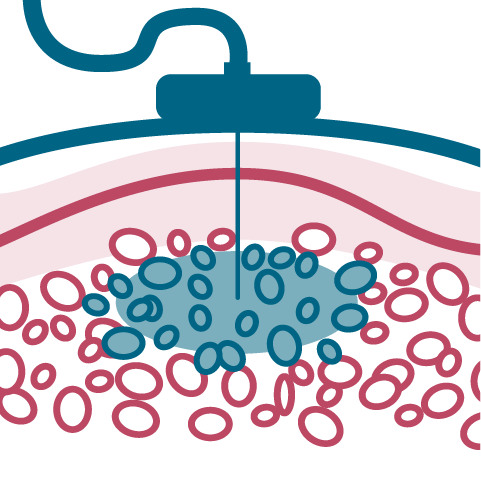
Tkanka podskórna w przypadku infuzji fSCIG
Rekombinowana hialuronidaza ludzka powoduje większe rozproszenie i absorpcję IG w tkance podskórnej.
* fSCIG (ang. facilitated subcutaneous immunoglobulin) – immunoglobulina do ułatwionego podawania podskórnego.
Bezpieczeństwo
Bezpieczeństwo hialuronidazy stosowanej m.in. w preparacie immunoglobulin weryfikowane było w wielu badaniach
Na modelu zwierzęcym potwierdzono, iż rHuPH20 jest dobrze tolerowana. Stosując u zwierząt dawki ponad 9000 razy większe niż te, które standardowo podaje się przy preparacie immunoglobulin, nie zaobserwowano wystąpienia stanu zapalnego między pierwszą a 28. dobą infuzji. Ponadto, hialuronidaza zminimalizowała miejscowe uszkodzenie tkanki podskórnej, znacząco zwiększyła rozprzestrzenianie się immunoglobulin w tkance podskórnej, redukując przy tym miejscowy obrzęk oraz ciśnienie wynikające z infuzji IgG. Nie obserwowano wpływu dużych dawek hialuronidazy na płodność, rozrodczość, rozwój płodowy oraz poporodowy.
Istnieją doniesienia świadczące o możliwości wytworzenia przez pacjentów przeciwciał przeciwko hialuronidazie (tzw. przeciwciał anty-rHuPH20). W badaniach zarówno przedklinicznych, jak i klinicznych zweryfikowano, czy obecność wspomnianych przeciwciał może mieć niekorzystny wpływ na zdrowie pacjenta bądź na skuteczność preparatu immunoglobulin.
W badaniach klinicznych 13 z 83 pacjentów (3 spośród 24 pacjentów pediatrycznych) rozwinęło przejściowe przeciwciała wiążące hialuronidazę. U tych pacjentów obecność przeciwciał nie miała wpływu na stężenie immunoglobulin w osoczu. Nie obserwowano także wzrostu liczby zakażeń czy też zwiększenia częstotliwości występowania zdarzeń niepożądanych.
Wyniki badań przedklinicznych wskazują, iż ekspozycja na przeciwciała anty-rHuPH20 nie wykazuje:
W badaniach klinicznych 13 z 83 pacjentów (3 spośród 24 pacjentów pediatrycznych) rozwinęło przejściowe przeciwciała wiążące hialuronidazę.
U tych pacjentów obecność przeciwciał nie miała wpływu na stężenie immunoglobulin w osoczu. Nie obserwowano także wzrostu liczby zakażeń czy też zwiększenia częstotliwości występowania zdarzeń niepożądanych.
O bezpieczeństwie hialuronidazy stosowanej w połączeniu z preparatem immunoglobulin (fSCIG) świadczy również fakt, iż istnieją pierwsze doniesienia o wykorzystaniu fSCIG u kobiet w ciąży.
Hialuronidaza: ponad 65 lat stosowania i doświadczeń klinicznych
Hialuronidaza: ponad 65 lat stosowania
1948 r.
Hialuronidaza dopuszczona do obrotu w Stanach Zjednoczonych
1960-2000 r.
Zgłaszano stosowanie hialuronidazy:
- podczas nawadniania podskórnego u pacjentów pediatrycznych
- do podawania leków
- do rozprowadzania leków znieczulających miejscowo
- w leczeniu bólu
2005 r.
Rekombinowaną hialuronidazę ludzką – rHuPH20 (Halozyme Therapeutics Inc.) dopuszczono do obrotu w Stanach Zjednoczonych (Uwaga: nie dopuszczono do obrotu jako samodzielny produkt na wszystkich rynkach UE)
2013 r.
fSCIG dopuszczona do obrotu w UE
2013 r.
Trastuzumab zatwierdzony do obrotu w UE
2014 r.
fSCIG dopuszczona do obrotu w Stanach Zjednoczonych
2014 r.
Rytuksymab zatwierdzony do obrotu w UE
2015 r.
W UE złagodzono ograniczenia stosowania fSCIG w związku z ciążą, laktacją i wpływem na płodność
2016 r.
fSCIG zatwierdzona przez Komisję Europejską do stosowania u pacjentów pediatrycznych w wieku 0-18 lat

Podsumowując, preparaty zawierające rekombinowaną hialuronidazę ludzką dostępne są na terenie Stanów Zjednoczonych i Europy od ponad 14 lat.
Dane z badań zarówno przedklinicznych, jak i klinicznych potwierdzają korzystny profil bezpieczeństwa rHuPH20.
Nie bez znaczenia jest również fakt, iż fSCIG jest skuteczną i bezpieczną opcją terapeutyczną, którą coraz szerzej stosuje się u kobiet w ciąży.
- Matysiak J. i wsp. ZNACZENIE HIALURONIDAZ WE WSPÓŁCZESNEJ MEDYCYNIE. Nowiny Lekarskie, 2013; 82, 2: 156-162.
- Wasserman R.L. i wsp. Recombinant human hyaluronidase-facilitated subcutaneous infusion of human immunoglobulins for primary immunodeficiency. J Allergy Clin Immunol, 2012; 130(4): 951-957.
- Wasserman R.L. i wsp. Recombinant human hyaluronidase-facilitated subcutaneous immunoglobulin infusion in primary immunodeficiency diseases. Immunotherapy, 2017; 9(12): 1035-1050.
- Wasserman R.L. i wsp. Recombinant human hyaluronidase facilitated subcutaneous immunoglobulin treatment in pediatric patients with primary immunodeficiencies: long-term efficacy, safety and tolerability. Immunotherapy, 2016; 8(10): 1175-1185.
- Borte M. i wsp. Presented at the 18th Biennial Meeting of the European Society for Immunodeficiencies; October 24–27, 2018; Lisbon, Portugal. Abstract # ESID8-0264.
- Więsik-Szewczyk E. i wsp. Medicine, 2018; 97(44); doi:10.1097/MD.0000000000012804.
- Frost G.I. Expert Opin Drug Deliv, 2007; 4: 427-440.
- Bookbinder L.H. i wsp. J Control Release, 2006; 114: 230-241.
- Shapiro S.D. i wsp. J Clin Invest, 1991; 87(5): 1828-1834.
- Toyama B.H., Hetzer M.W. Nat Rev Mol Cell Biol, 2013; 14(1): 55-61.
- HyQvia – UE Charakterystyka Produktu Leczniczego, wrzesień 2021.
- Yocum R.C. i wsp. J Infus Nurs, 2007; 30(5): 293-299.
- Na podstawie Charakterystyki Produktu Leczniczego: https://www.accessdata.fda.gov/drugsatfda_docs/label/2012/021859s009lbl.pdf., dostęp: luty 2022.
- Stovner J. i wsp. Cancer Chemother Rep, 1962; 21: 147-148.
- Parkes M. i wsp. Arch Ophthalmol, 1973; 89(4): 324-328.
- Borg P.A., Krijnen H.J. Pain, 1994; 58(2): 273-276.
- Na podstawie Charakterystyki Produktu Leczniczego: https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/103792s5347lbl.pdf., dostęp: luty 2022.
- Na podstawie Charakterystyki Produktu Leczniczego: https://www.ema.europa.eu/documents/product-information/mabthera-epar-product-information_pl.pdf., dostęp: luty 2022.